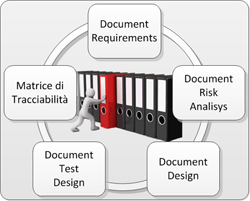
Già dal momento dell'ideazione, alla progettazione fino alla realizzazione e validazione, Novagem Solutions segue un percorso di sviluppo specifico ponendo estrema considerazione anche alla redazione della necessaria documentazione. Nella fase di acquisizione delle specifiche, viene redatto il Documento dei requisiti, che guida e permette di definire una migliore comprensione del problema. Ne segue un documento di Risk Analisys in cui vengono trattati tutti gli aspetti di fattibilità del sistema in termini di sicurezza, robustezza, fedeltà del dato da trattare. Trasversalmente si pone attenzione ad aspetti come l'eventuale futura estendibilità del progetto e l'interfacciamento con sistemi e protocollo standard. Dopo la realizzazione della soluzione, la successiva fase prevede la stesura del Design Document che dichiara in che modo i sottosistemi sono stati affrontati ed implementati. Si prosegue quindi con la progettazione dei protocolli di test di debug per la verifica dei sistemi detta anche fase di Test Design. Quando il software è pronto viene "congelato" ed etichettato con una release interna precisa di riconoscimento e la fase di Test Execution può avere luogo. Viene quindi redatta la Matrice di tracciabilità che copre l'intero percorso verifica e validazione.
|
|
Il carattere di sicurezza e tracciabilità che permea il settore biomedicale richiede sempre più frequentemente la progettazione di soluzioni Part-11 compliant.
Part-11 identifica una serie di linee guida per l'acquisizione, la conservazione e la manipolazione di dati in formato elettronico, definite all'interno del Code of Federal Regulations, redatto dall'ente statunitense FDA (Food and Drug Administration). Seguendo i criteri e le disposizioni Part-11 si certifica che i dati elettronici hanno stessa valenza dei dati cartacei. Vengono certificati i processi di gestione del dato, partendo dalla creazione, alla modifica, all'archiviazione, al recupero ed alla trasmissione. Devono necessariamente sottostare a tali principi enti che offrono servizi o prodotti nei settori dell'alimentazione, della medicina, del settore farmaceutico, della biotecnologia, della ricerca biologia e biotech, della salute pubblica e della cosmesi.
Audit trail certifica la revisione di un programma, ma anche in generale di dati, permettendo di gestire e tenere traccia dello storico delle transazioni che lo riguardano. Vengono identificati tutti gli step di un processo o dato, partendo dalla sua creazione fino al completamento del servizio, tracciando incrementalmente le modifiche, con la possibilità di eseguire un roll back.
|